Équipe Philippe MARIN
Neuroprotéomique et signalisation des pathologies cérébrales
Projet Identification et analyse fonctionnelle des biomarqueurs de sclérose en plaques
RESPONSABLE

Personnel IGF impliqué
Manon RIVAL
Doctorante, Tutelle
La sclérose en plaques (SEP) est une maladie auto-immune qui affecte le système nerveux central (SNC), caractérisée par des plages de démyélinisation avec infiltration lymphocytaire et macrophagique. L’activation gliale chronique au niveau de ces plaques inhibe la remyélinisation et engendre des lésions axonales, associées à la progression du handicap à long terme. Il existe de multiples facteurs de risque génétiques et environnementaux incluant la carence en Vitamine D et l’infection à EBV, mais leur rôle dans l’activation du système immunitaire reste encore mal défini. L’analyse des effets de la Vitamine D sur le système immunitaire et la recherche de biomarqueurs de SEP dans le sang et dans le liquide céphalo-rachidien (LCR) sont des enjeux majeurs pour mieux comprendre la physiopathologie de la maladie et développer de nouvelles thérapies visant à protéger ou réparer la myéline.
Le projet se concentre sur l’identification de nouveaux biomarqueurs de la sclérose en plaques (SEP) en utilisant des techniques de protéomique. L’analyse d’échantillons de liquide céphalorachidien (LCR) comparant les patients atteints de SEP avec des témoins grâce à une méthode d’immunoprécipitation puissante pour éliminer les 20 protéines plasmatiques les plus abondantes du LCR a permis de caractériser en profondeur le protéome du LCR, y compris les protéines à faible abondance sécrétées par les cellules du système nerveux central. En parallèle, l’utilisation du marquage isotopique stable en culture cellulaire (SILAC) pour étudier le sécrétome neuronal a permis d’identifier plusieurs marqueurs de lésions neuronales induites lors de l’inflammation ou de l’apoptose. Ces travaux ont abouti à l’identification de CHI3L1 et CHI3L2 comme biomarqueurs validés de la SEP dans le LCR, avec une expression accrue dans les plaques de SEP dans le cerveau des patients atteints de cette maladie. De plus, j’ai analysé la valeur pronostique des niveaux de CHI3L1 dans le LCR chez les patients atteints de RIS (syndrome radiologiquement isolé cliniquement).
Récemment, grâce aux avancées technologiques en protéomique, notre équipe a identifié de nouveaux biomarqueurs de la SEP, dont syndecan-1 (aussi connu comme CD138, un marqueur des plasmocytes), validé par la spectrométrie de masse en réaction parallèle (PRM) (brevet N° 18305630.8, 22 mai 2018). Curieusement, Syndecan-1 est exprimé dans les cellules précurseurs oligodendrocytaires (OPC) et agit comme récepteur pour CHI3L1 dans plusieurs modèles. La Chitinase 3-like protein 1 (CHI3L1) est un biomarqueur de SEP sécrété par les astrocytes, les cellules microgliales et les macrophages. Elle est impliquée dans le remodelage de la matrice extracellulaire via son association à différentes protéines membranaires, incluant le récepteur CRTH2 et le Syndecan-1, un autre biomarqueur de SEP exprimé dans les cellules progénitrices d’oligodendrocytes (OPC) et discriminant la SEP des autres pathologies inflammatoires. Les résultats préliminaires de l’équipe suggèrent que dans la SEP, la CHI3L1 pourrait affecter la différenciation des OPC en oligodendrocytes matures impliqués dans la remyélinisation.
Nous voulons étudier le rôle du complexe CHI3L1-SDC1 dans la différenciation des OPC et la remyélinisation en utilisant des lignées d’OPC de murins et des OPC dérivés de cellules souches pluripotentes humaines (hiPSC-OPC). Ce projet déterminera si le complexe CHI3L1-SDC1 et les voies de signalisation qu’il contrôle constituent des cibles pour une nouvelle stratégie thérapeutique dans la SEP, en particulier pour les formes progressives de la maladie.
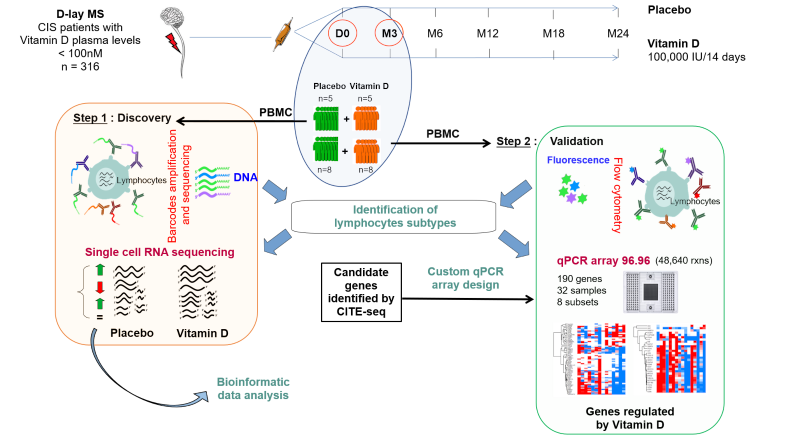
Notre projet de recherche porte également sur le potentiel thérapeutique de la vitamine D dans la sclérose en plaques (SEP). Avec les résultats de l’étude clinique D-lay MS, la plus grande étude clinique en double aveugle visant à évaluer l’efficacité clinique de la vitamine D pour réduire la conversion en SEP après un syndrome cliniquement isolé, nous souhaitons analyser les mécanismes immunomodulateurs de la vitamine D in vivo dans la SEP et chez les sujets sains. Grâce à de nombreux échantillons en bio-collection, nous développons des analyses fonctionnelles de la modulation de l’activité des lymphocytes par la vitamine D et analysons les modifications de l’expression génique dans les lymphocytes circulants de patients atteints de SEP par single-cell RNA sequencing.
Disposant d’une étude clinique en miroir chez les sujets sains, grâce à de nombreuses collaborations, nous voulons maintenant analyser les effets de la vitamine D dans l’espèce humaine au niveau lymphocytaire, mais aussi du microbiote intestinal et sanguin, ainsi que du métabolome plasmatique. Les résultats de ces projets permettront de mieux comprendre les effets immunorégulateurs de la vitamine D en population générale, d’optimiser la prévention primaire de la SEP et des maladies auto-immunes chez les sujets sains, et d’ouvrir la voie à de nouvelles cibles thérapeutiques pour le traitement de la SEP.
Principales publications
• Hinsinger, G. et al. (2024) Neurol Neuroimmunol Neuroinflamm 11, e200230
• Rival, M. et al. (2023) Neurol Neuroimmunol Neuroinflamm 10, e200044
• Galoppin, M. et al. (2023) bioRxiv 2023.09.25.559400
• Galoppin, M. et al. (2022) Brain Commun 4, fcac171
• Conejero, I. et al. (2022) Brain 145, 3264-3273
• Rival, M., et al. (2022) Front. Immunol. 13, 866092
• Gauthier, A. et al. (2021) Annals of Clinical and Translational Neurology doi:10.1002/acn3.51355.
• Thouvenot, E. et al. (2020) Eur J Neurol 27, 251-257
• Camu, W. et al. (2019) Neurol Neuroimmunol Neuroinflamm 6, e597
• Thouvenot, E. et al. (2018) Mult. Scler. 1352458518767043
• Prin, P. et al. (2017) Ann. Neurol. 82, 489-490
• Nerrant, E et al. (2016) Neurology 86, e38-39
• Thouvenot, E., et al. (2015) Eur J Neurol 22, 564-569
• Hinsinger, G., et al. (2015) Mult Scler, 21(10):1251-61
• Thouvenot, E. et al. (2012) J Proteomics 77, 394-405
• Rigau, V. et al. (2012) Neurology 79, 2214-2216
• Thouvenot, E. et al. (2008) Journal of Proteome Research 7, 4409-4421
• Thouvenot, E. et al. (2006) Proteomics 6, 5941-52
Financements
• 2024-2027 Université Montpellier / CHU Nîmes – CITE-VDSS – Coordonnateur
• 2021-2024 National MS Society – ProBioRIS – Partenaire
• 2020-2021 ARSEP – Coordonnateur
• 2019-2022 ANR PRCI – VITADIMS – Partenaire
• 2019-2021 ARSEP – Partenaire
• 2014-2016 Genzyme- BioCoMS – Coordonnateur
• 2015-2016 ARSEP – Coordonnateur
• 2013-2014 ARSEP – Coordonnateur
• 2012-2015 Université Montpellier – CHU Nîmes – Coordonnateur
• 2009-2011 ARSEP – Coordonnateur
• 2008-2009 ARSEP – iTRAQ – Coordonnateur
• 2005-2007 Poste d’accueil Inserm – PhD
• 2003-2004 FRM – Master 2
Collaborations
• Anne Astier (Toulouse)
• Britta Engelhardt (Bern)
• Catherine Lubetzki (Paris)
• Sylvain Lehmann (Montpellier)
• Sophie Assant (Lyon)
Alumni
• Manon Rival (Thèse, 2024-2027)
• Manon Galoppin (Thèse, 2020-2023)
• Lucile du Trieu de Terdonck (Thèse, 2018-2022)
• Geoffrey Hinsinger (Thèse, 2014-2018)
Brevets
• Thouvenot E., Marin P., Urbach S., Hinsinger G. EPO 18305630.8, 2018
• Marin P., Thouvenot E., Nguyen G., Groszer M. WO 2013/124406 A1, 2013


