Équipe Philippe LORY
Canaux ioniques : excitabilité neuronale et canalopathies
Projet Couplage stimulation-sécrétion dans le tissu médullosurrénalien : physiopathologie de la réponse adaptative au stress et pathologies associées
RESPONSABLE

Personnel IGF impliqué
Claire BERNAT
IECN CNRS
Arnaud MONTEIL
CRHC CNRS
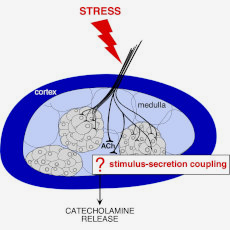
La sécrétion d’hormones est une fonction physiologique soumise à des régulations fines afin de répondre aux besoins de l’organisme. En situation de stress, les cellules chromaffines du tissu médullosurrénalien libèrent des catécholamines (adrénaline notamment) permettant à l’organisme de mettre en place une réponse adaptative. Cette sécrétion est sous le contrôle de plusieurs mécanismes, cellulaires et tissulaires, dont la coordination est essentielle au maintien de l’homéostasie de l’organisme. De fait, tout changement de l’un de ces mécanismes peut impacter la libération hormonale, avec des conséquences sur la physiologie de l’organisme.
Influence du microbiote intestinal sur la réponse au stress du tissu médullosurrénalien
Rôle de l’excitabilité des cellules chromaffines dans la régulation de la sécrétion de catécholamines : contribution des conductances de fuite sodiques
Dans le contexte de l’excitabilité, nous nous intéressons aux canaux ioniques opérant autour du potentiel membranaire de repos des cellules. Nous avons mis en évidence dans des tranches de glande surrénale de souris, une conductance perméable aux ions Na+ (portée par les canaux de fuite sodique NALCN?), régulant l’activité électrique des cellules chromaffines. Le rôle de NALCN dans l’excitabilité des cellules chromaffines et dans la sécrétion des catécholamines, est étudié dans un modèle murin génétiquement manipulé pour inactiver l’expression de NALCN dans les cellules chromaffines.
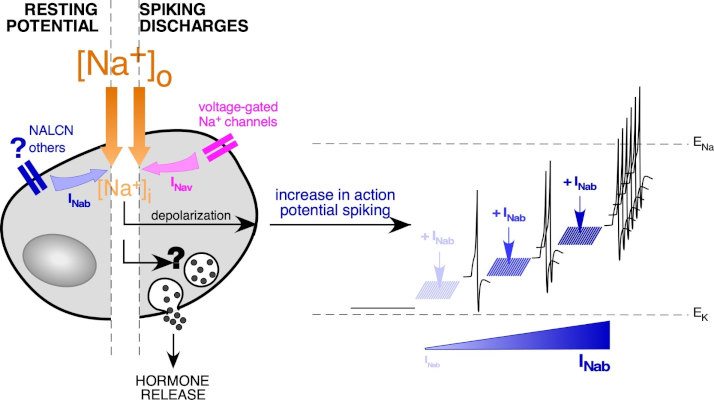
Représentation schématique de l’homéostasie du Na+ dans une cellule chromaffine : focus sur l’entrée de Na+ médiée par les canaux ioniques. La différence de concentration en Na+ entre le cytoplasme (~10 mM) et le milieu extracellulaire environnant (~140 mM) favorise un flux entrant de Na+ lorsque les canaux perméables au Na+ s’ouvrent. Cette entrée de Na+ contribue à la dépolarisation de la cellule. Au niveau du potentiel de repos, la présence de canaux perméants au Na+ (NALCN, …) génère un influx persistant de Na+ (appelé ici INab). Plus le courant INab est important, plus la valeur du potentiel de repos tend vers des potentiels positifs. D’après Guérineau et al., Front Neuroendocrinol, 2021.
Principales publications
• Monteil A., et al. (2024) Physiol Rev, 399, 472.
• Guérineau NC (2023) Methods Mol Biol, 2565, 113-127.
• Milman A., et al. (2021) J Physiol, 599, 1855-1883.
• Guérineau NC., et al. (2021) Front Neuroendocrinol, 63, 100947.
Financements
• 2015-2024 ANR LabEx « Ion Channels, Science and Therapeutics » – Partenaire
Collaborations
• Pierre Fontanaud (Montpellier)
• Stéphanie Ventéo (Montpellier)
• Jean-Louis Bossu (Strasbourg)
Alumni
• Alexandre Milman (Thèse)
Plasticité du couplage stimulation-sécrétion du tissu médullosurrénalien en réponse à l’hypertension artérielle
Une sécrétion accrue (élevée et/ou prolongée) de catécholamines est facteur de risque de pathologies, notamment cardiovasculaires à l’image de l’hypertension artérielle. Sur le modèle du rat génétiquement hypertendu (SHR), nous étudions la plasticité des déterminants du couplage stimulation-sécrétion, à savoir l’excitabilité des cellules chromaffines, la transmission synaptique cholinergique entre le nerf splanchnique et les cellules chromaffines et le couplage électrique médié par les jonctions gap entre cellules chromaffines.
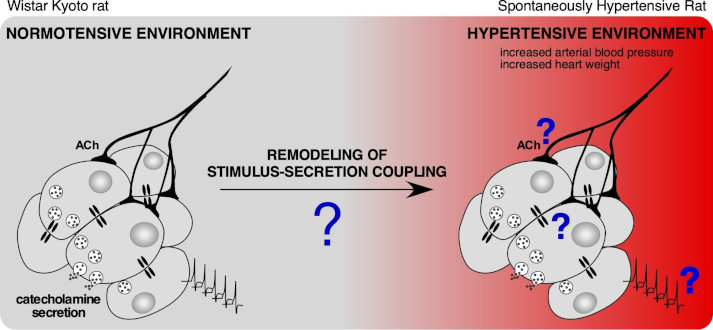
Représentation schématique du couplage stimulation-sécrétion du tissu médullosurrénalien. Quel est l’impact d’un environnement hypertensif sur les mécanismes cellulaires/intercellulaires impliqués dans ce couplage ? Quelle en est la conséquence sur la sécrétion de catécholamines ? D’après Paillé et al., Résultats non publiés.
Principales publications
• Paillé V., et al. (2024) Cell Mol Life Sci, 82, 31.
• Guérineau NC (2024) Vitam Horm, 124, 221-295.
• De Nardi F., et al. (2017) Front Endocrinol, 8, 248.
Financements
• 2014 Angers Loire Métropôle – Coordonateur
• 2013 Conseil Général de Maine et Loire – Coordonateur
• 2012 Angers Loire Métropôle – Coordonateur
• 2010 FRM – Coordonateur
• 2010 Région Pays de la Loire – Coordonateur
• 2010 Conseil Général de Maine et Loire – Coordonateur
• 2010 Angers Loire Métropôle – Coordonateur
Collaborations
• Vincent Paillé (Nantes)
• Christian Legros (Angers)
• Daniel Henrion (Angers)
• Jennifer Bourreau (Angers)
• Bertrand Toutain (Angers)
• Joohee Park (Angers)
• Frédéric de Nardi (Angers)
• Dimitri Bréard (Angers)
Alumni
• Vincent Paillé (Post-doctorat)
• Frédéric de Nardi (Post-doctorat)
• Claudie Lefort (Master 2)
Influence du microbiote intestinal sur la réponse au stress du tissu médullosurrénalien
Les situations de stress chronique ou les réponses dérégulées au stress sont des facteurs de risque de développer des pathologies neurologiques telles que la dépression et l’anxiété. Les glandes surrénales (en particulier la région médullaire) jouant un rôle majeur dans la réponse adaptative au stress, l’identification de nouvelles cibles capables d’affecter la fonction sécrétrice des glandes surrénales est un défi actuel. Dans ce contexte, le microbiote intestinal est une cible émergente. Sur un modèle de souris dont la composition du microbiote a été modifiée, nous avons montré que l’expression du gène codant pour la phényléthanolamine N-méthyltransférase (PNMT, enzyme catalysant l’épinéphrine à partir de la norépinéphrine) est plus élevée chez les animaux ayant subi un stress chronique que chez les animaux contrôles.
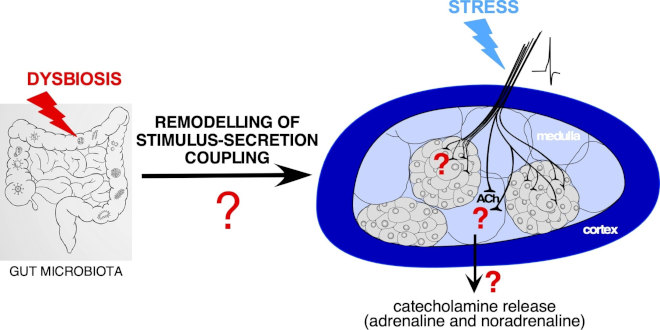
Microbiote intestinal et couplage stimulation-sécrétion du tissu médullosurrénalien. Quel est l’impact d’une dysbiose du microbiote intestinal sur les mécanismes cellulaires / intercellulaires impliqués dans le couplage stimulation-sécrétion du tissu médullosurrénalien ? Quelle en est la conséquence sur la sécrétion de catécholamines et sur la réponse adaptative au stress ?
Principales publications
• Mir HD., et al. (2020) Psychoneuroendocrinology, 119, 104750.
Collaborations
• Sylvie Rabot (Jouy en Josas)
Alumni
• Alexandre Milman (Thèse)


