Équipe Philippe LORY
Canaux ioniques : excitabilité neuronale et canalopathies
Projet Comprendre le rôle des canaux calciques dans les maladies du neurodéveloppement
RESPONSABLE

Personnel IGF impliqué
Sophie NICOLE
CRHC INSERM
Claire BERNAT
IE CNRS
Arnaud MONTEIL
CRHC CNRS
Amaël DAVAKAN
Doctorant CNRS
Clément MARCHAL
Doctorant UM
Des mutations de canaux calciques voltage-dépendants (Cav) sont une cause croissante de maladies du neurodéveloppement. C’est le cas de l’ataxie spinocérébelleuse 42, SCA42ND, causée par des mutations de novo, gain de fonction, dans le gène CACNA1G codant pour le canal calcique Cav3.1, qui associe atrophie cérébelleuse précoce, microcéphalie, épilepsie, avec un développement moteur et cognitif retardé. Nous étudions les conséquences électrophysiologiques et structurales de ces mutations. Les mutations associées à un phénotype clinique sévère sont gain-de-fonction et déstabilisent le ‘gating’ (propriétés d’activation et d’inactivation du canal), en particulier la mutation récurrente p.A961T pour laquelle un modèle murin permet d’étudier les défauts moteurs cérébelleux.
Nous utilisons des approches in vitro (patch-clamp …) et in silico (modélisation neuronale, dynamique moléculaire …) pour caractériser les conséquences des mutations des canaux Cav3 situées sur les portions intracellulaires des segments S5 et S6 définissant l’intracellular gate’. Nous développons des nouveaux modèles animaux pour l’étude de ces mutations afin d’évaluer l’implication physiopathologique de ces canaux dans le neurodéveloppement. Nous recherchons de nouvelles stratégies thérapeutiques potentiellement efficaces pour traiter ces canalopathies complexes.
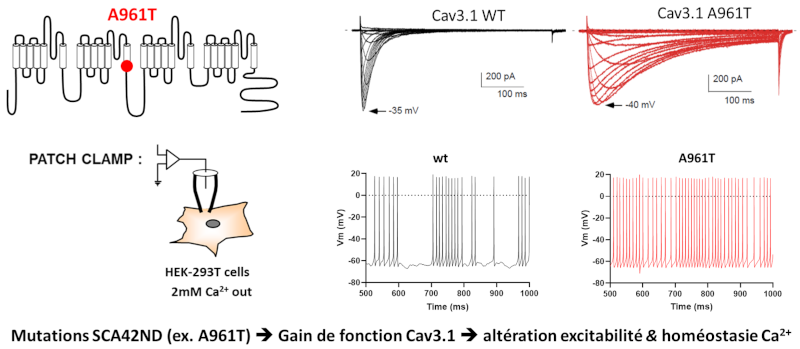
Caractérisation fonctionnelle et structurale des mutations de novo, faux sens, responsables de maladies sévères du neurodéveloppement (ex SCA42ND). Le patch-clamp permet de mesurer les altérations électrophysiologiques causées par la mutation p.A961T (en haut à droite) et la modélisation neuronale permet d’apprécier la nature ‘gain-de-fonction’ de la mutation avec l’augmentation du nombre de potentiel d’action produit par les neurones du cervelet (en bas à droite).
Principales publications
• Lory P, et al. (2020) Pflugers Arch. 472(7):831-844 (review).
• Chemin J, Siquier-Pernet K, et al. (2018) Brain. 141(7):1998-2013.
• Dorgans K, Salvi J, et al. (2017) Neurobiol Dis. 106:110-123.
• Cazade M, et al. (2017) Elife. 6:e22331.
• Daniil G, et al. (2016) EBioMedicine 13:225-236.
• Blesneac I, et al. (2015) Proc Natl Acad Sci U S A. 112(44):13705-10.
• Coutelier M, Blesneac I, et al. (2015) Am J Hum Genet. 97(5):726-37.
• Salvi J, et al. (2014) Neurobiol Dis. 68:47-56.
Financements
• 2023-2027 – ANR PRC ‘CaCh-Investigation’ project, coordinator (PI)
• 2012-2024- LabEx ICST ‘Ion Channels Science & Therapeutics’, partner
• 2023-2024 – Fondation Connaitre les Syndromes Cérébelleux (CSC), PI
• 2019-2020 – FMR (Fondation Maladies Rares) “animal models” grant, PI
Collaborations
• Vincent Cantagrel (Paris)
• Marion Coolen (Paris)
• Philippe Isope (Strasbourg)
• Xiaojing Cong (Montpellier)
Alumni
• Iulia Blesneac (Postdoc, 2011-2015)


