Équipe Chris JOPLING
Développement, Pathologies et Régénération Cardiaques
Projet Identification des mécanismes cellulaires et moléculaires à l’origine de la régénération cardiaque
RESPONSABLE

Personnel IGF impliqué
Jourdano MANCILLA ABAROA
Doctorant INSERM
Adèle FAUCHERRE
CRCN CNRS
Thomas MOORE MORRIS
CRCN INSERM
Aurélien DROUARD
IE CNRS
Crystal GUILLEMIN
IE CNRS
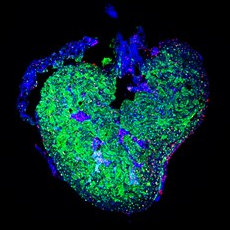
Les maladies cardiaques sont devenues l’une des causes les plus fréquentes de décès. En effet, de nombreux pays européens signalent que les maladies cardiaques sont la première cause de décès et d’invalidité. Si les mammifères adultes sont incapables de régénérer leur cœur de manière significative, ce n’est pas le cas d’un certain nombre d’autres espèces de vertébrés. Comprendre comment ces animaux sont capables de régénérer leur cœur permettra de mieux comprendre comment ce processus peut être induit chez l’homme afin d’inverser les dommages causés par l’infarctus du myocarde.
Métabolisme et régénération cardiaques
Inflammation et régénération cardiaques
Métabolisme et régénération cardiaques
Les mécanismes de renouvellement des cardiomyocytes sont largement inconnus. Parmi les voies de signalisation récemment identifiées, la voie Hippo, l’exposition du myocarde à l’oxygène et le statut métabolique des cardiomyocytes sont décrits comme déterminant les capacités de prolifération des cardiomyocytes et sont donc essentiels pour la régénération cardiaque. Néanmoins, la manière dont l’état hypoxique et métabolique des cardiomyocytes est contrôlé reste à déterminer. Notre hypothèse principale est que l’interaction entre la signalisation hypoxique et métabolique est d’une importance cruciale pour la régénération du cœur adulte.
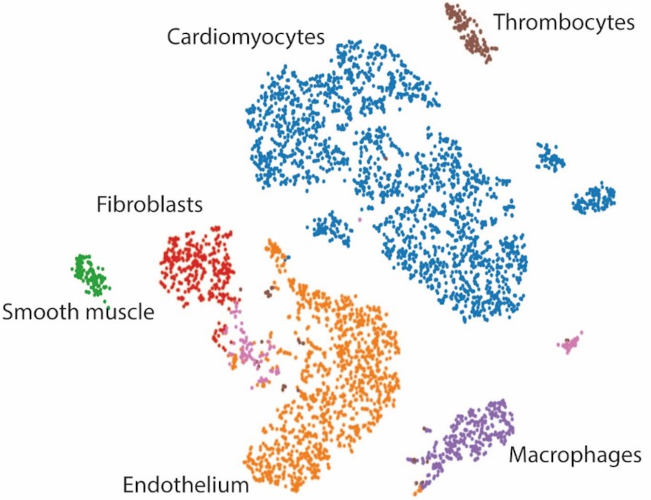
L’analyse transcriptomique à l’échelle du noyau unique de cœurs en régénération nous permet d’identifier les gènes métaboliques qui régulent la prolifération des cardiomyocytes.
Principales publications
• Jopling C., et al. (2012) Circulation.18;126(25):3017-27.
Financements
• 2022-2025 ANR METABOX – Partenaire
Collaborations
• Francesca Rochais (Marseille)
Inflammation et régénération cardiaques
Les macrophages jouent un rôle important pendant la régénération cardiaque. Notre analyse de la population de macrophages a révélé que la réponse inflammatoire des macrophages résidents suivie de l’invasion des macrophages recrutés semble être remarquablement similaire à la réponse observée chez les mammifères adultes après une blessure, bien que plus rapide. En outre, nous avons constaté que les macrophages recrutés ont besoin de la métalloprotéase matricielle Mmp14 pour envahir la région de la blessure et promouvoir la régénération cardiaque.
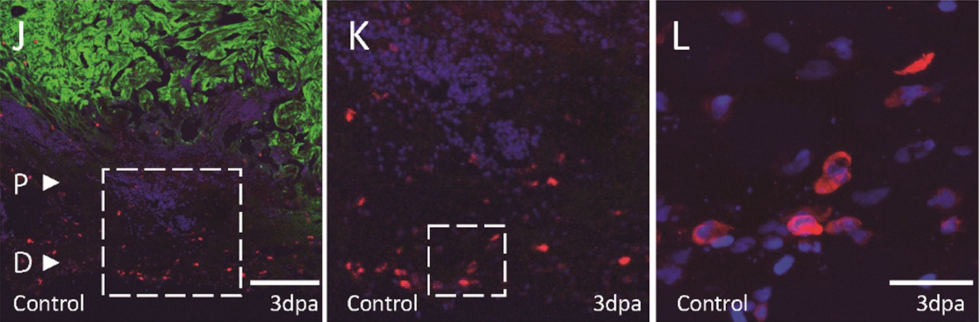
Macrophages (rouge) envahissant la région de la plaie d’un cœur endommagé (vert)
Principales publications
• Rolland L., et al. (2023) J Mol Cell Biol, 14(10)
Mécanosensation et régénération cardiaques
Les lésions myocardiques causées, par exemple par l’ischémie cardiaque, entraînent une surcharge du volume ventriculaire qui se traduit par un étirement accru du myocarde restant. Chez l’homme, ces changements déclenchent une hypertrophie des cardiomyocytes qui se traduit par une insuffisance cardiaque. Inversement, en réponse à des lésions myocardiques importantes, les cardiomyocytes des espèces régénératrices prolifèrent et régénèrent complètement le myocarde endommagé. Notre objectif est de déterminer comment les modifications des forces mécaniques dues aux lésions du myocarde peuvent être détectées par des mécanocapteurs qui, à leur tour, peuvent déclencher la régénération cardiaque.
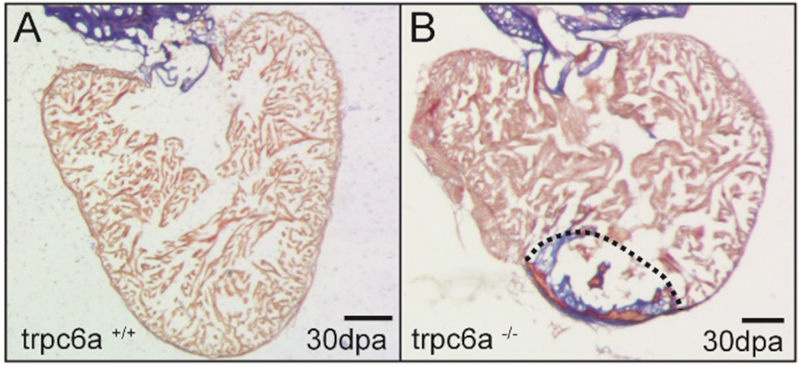
Le mécanosenseur Trpc6 est nécessaire à la régénération du cœur. Le cœur de type sauvage (A) s’est complètement régénéré après 30 jours. Le cœur Trpc6 KO ne s’est pas régénéré et une large cicatrice persiste. Rolland L., et al. (2024)
Principales publications
• Rolland L., et al. (2024) Front Cardiovasc Med, 10:1186086.
Collaborations
• Francesca Rochais (Marseille)
Cardiotoxicité des polluants environnementaux
Des preuves récentes indiquent que les polluants environnementaux tels que le bisphénol A et les acides perfluorés peuvent potentiellement avoir un impact sur le développement humain et la santé. Notre objectif est de déterminer si les polluants environnementaux peuvent perturber le développement et la physiologie cardiaques. Pour ce faire, nous utilisons des modèles in vivo en conjonction avec une cartographie optique de pointe et des tests cardiaques et comportementaux à haut débit.
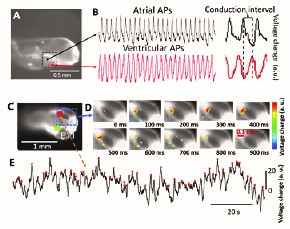
Optical mapping: séries temporelles de l’activité cardiaque et neuronale chez les larves de poisson zèbre. A) Vue latérale d’une larve de poisson zèbre. Le carré en pointillé indique la zone cardiaque. (B) : potentiels d’action auriculaires et ventriculaires. L’encart montre l’intervalle de conduction entre les signaux auriculaires et ventriculaires. C,D) Vue dorsale d’une larve de poisson zèbre. Les curseurs orange et vert indiquent les régions typiques ciblées pour l’enregistrement de l’activité cérébrale.) E) Exemple de série temporelle de dépolarisation (région ciblée indiquée par une ligne pointillée en C,D).
Principales publications
• Forner-Piquer I., et al. (2021) Environ Pollut. 22;278:116755.
• Forner-Piquer I., et al. (2021) Chemosphere. 267:128986.
Financements
• 2019 MUSE Pestifish – Partenaire
• 2023 ANSES Optifish – Partenaire
Collaborations
• Nicola Marchi (IGF, Montpellier)
• Angelo Torrente (IGF, Montpellier)


