Équipe Chris JOPLING
Développement, Pathologies et Régénération Cardiaques
Projet Identification des facteurs impliqués dans le développement et les maladies cardiaques
RESPONSABLE

Personnel IGF impliqué
Victor BERNARD
Doctorant, UM
Chris JOPLING
CRCN, INSERM
Thomas MOORE-MORRIS
CRCN, INSERM
Aurélien DROUARD
IE, CNRS
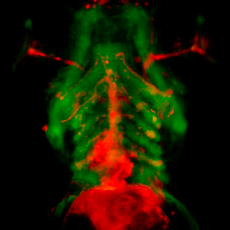
A l’aide de diverses approches in vitro et in vivo et en particulier grâce au modèle poisson-zèbre, nous nous intéresserons au développement normal et pathologique du cœur. Notre objectif est d’identifier les facteurs dont les dérégulations conduisent à des cardiopathies congénitales chez l’homme avec un intérêt particulier pour le rôle des forces hémodynamiques sur l’homéostasie de la matrice extracellulaire et le rôle du canal ionique mécanosensible Piezo sur le développement et la rythmicité cardiaques.
Rôle des forces hémodynamiques sur l’homéostasie de la matrice extracellulaire cardiaque
Rôle des forces hémodynamiques sur l’homéostasie de la matrice extracellulaire cardiaque
En utilisant une combinaison d’approches transcriptomiques (scRNAseq, snRNAseq), génomique (séquençage d’ADN de patients), in vitro (cultures cellulaires soumises à des forces mécaniques, électrophysiologie) et in vivo chez le poisson zèbre et les mammifères, notre objectif est d’identifier les voies de signalisation nécessaires à la mécanotransduction des forces hémodynamiques contrôlant l’expression et l’homéostasie de la matrice extracellulaire cardiaque et de déterminer si elles sont associées à des anomalies cardiaques congénitales chez l’homme.
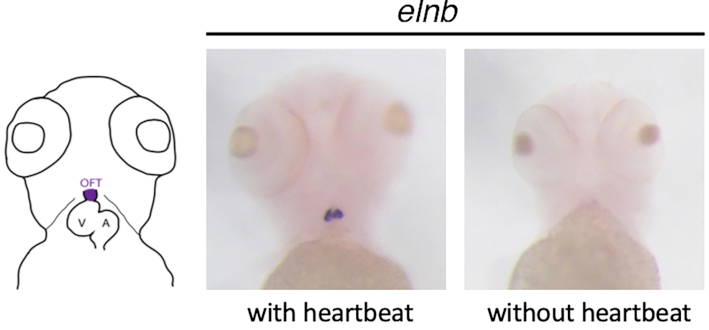
Hybridation in situ contre l’élastine b, un composant de la matrice extracellulaire exprimé au niveau de la chambre d’éjection cardiaque. Si les battements cardiaques (et donc les forces hémodynamiques) sont ihnibés chez le poisson-zèbre, l’Élastine n’est plus exprimée.
Principales publications
• Faucherre A., et al. (2020), J Mol Cell Cardiol. 143:51-62.
• Rambeau R. et al. (2017), Int J Cardiol. 15;249:340-343
Financements
• 2012-2025 Labex ICST, ANR-11-LABX-0015 -Membre
Collaborations
• Stéphane Zaffran (MMG, Marseille)
Alumni
• Pierre RAMBEAU (thèse)
Canaux mécano-sensibles et rythme cardiaque
Nous nous intéressons à l’effet du canal ionique mécanosensible Piezo1 sur la rythmicité cardiaque. A l’aide plusieurs approches incluant la vidéo microcopie, la cartographie optique ou l’enregistrement d’électrocardiogrammes, nous étudions l’effet de l’activation de ce canal sur la fréquence cardiaque et son implication dans les pathologies humaines telles que la fibrillation atriale.
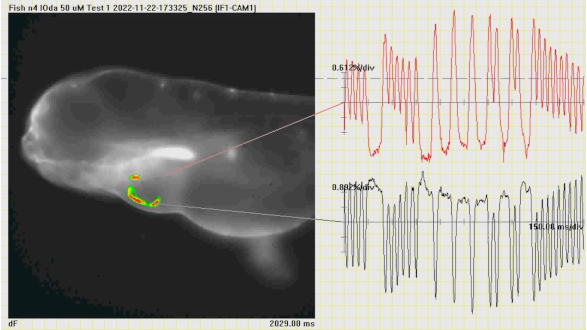
Analyse à l’aide de la cartographie optique de la diffusion des potentiels d’action cardiaques d’un poisson traité par un agoniste du canal ionique Piezo1. From Rolland L., et al. 2033
Principales publications
• Rolland L., et al. (2023) Int J Mol Sci. 24(7):6720.
Financements
• 2012-2025 Labex ICST, ANR-11-LABX-0015 – Membre
Collaborations
• Philippe Chevalier (Hospices Civils de Lyon)
• Angelo Torrente (IGF, Montpellier)
• Emmanuel Bourinet (IGF, Montpellier)
Alumni
• Laura ROLLAND (Thèse)
• Dounia MASKINI (Master)
Variants génétiques et cardiopathies congénitales
Nous utilisons le modèle poisson-zèbre pour étudier la pathogénicité de variants humains et leur implication dans les cardiopathies congénitales.
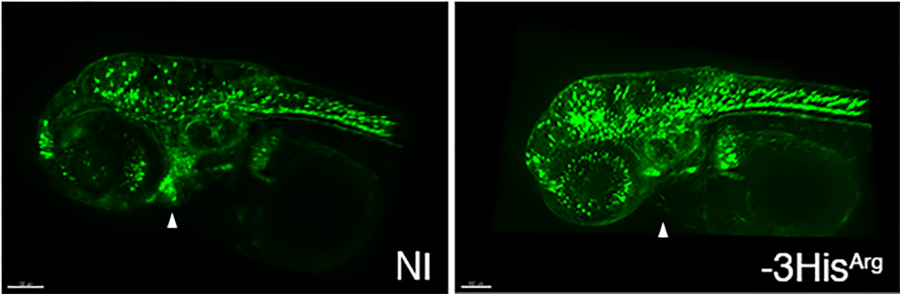
Projection maximale de larves de poisson-zèbre de 3 jours exprimant la GFP sous contrôle du promoteur sox10 (crête neurale). Un défaut de migration des cellules de la crête neurale est observé chez le poisson injecté avec le variant humain -3HisArg associé à des défauts de la valve aortique chez l’homme. (NI : non injecté). From Odelin G., Faucherre A. et al. (2023) Nat Commun. 14(1):1543
Principales publications
• Janin A., et al. (2023) Circ Genom Precis Med (3):277-279
• Odelin G., Faucherre A. et al. (2023) Nat Commun. 14(1):1543
• Jaouadi H. et al. (2023) J Transl Med 21(1):160
• Moreau A. (2021) Clin Transl Med. 11(3):e319
• Faucherre A., et al. (2020), J Mol Cell Cardiol. 143:51-62.
Collaborations
• Stéphane Zaffran (MMG, Marseille)
• Philippe Chevalier (Hospices Civils de Lyon)


