Équipe Stéphanie BARRÈRE-LEMAIRE – Matteo MANGONI
Cardioprotection, physiopathologie du rythme cardiaque et ischémie
Projet Etude des mécanismes de mort cellulaire au cours de l’ischémie-reperfusion myocardique et développement de stratégies cardioprotectrices
RESPONSABLE

Personnel IGF impliqué
Anne VINCENT
PU UM
Christian BARRERE
IEHC CNRS
Joël NARGEOT
DRCE Emérite CNRS
Matteo E. MANGONI
DR1 CNRS
Manon MARROT
Doctorante CNRS
Mélanie FAURE
Doctorante UM
Oscar THABOUILLOT
Doctorant, UM
L’infarctus du myocarde (IDM) est la première cause de mortalité cardiovasculaire dans le monde. Le challenge est de développer des stratégies cardioprotectrices pour limiter la taille de l’infarctus et réduire la morbi-mortalité des patients. Empêcher la mort cellulaire à la phase aiguë de l’IDM n’est possible que si l’on réouvre l’artère occluse le plus rapidement possible pour restaurer le flux sanguin. Cependant, cette reperfusion s’accompagne d’effets indésirables liés au retour brutal de l’oxygène induisant l’apoptose des cellules cardiaques. Actuellement, il n’existe aucun traitement inhibant les lésions d’ischémie-reperfusion (IR) et diminuant la taille d’infarctus. Notre équipe développe différentes approches cardioprotectrices afin de diminuer la taille de l’infarctus.
Développement de peptides anti-apoptotiques cardioprotecteurs
Préconditionnement des cellules souches/stromales mésenchymateuses par PPARβ⁄δ
Développement de peptides anti-apoptotiques cardioprotecteurs
Nous avons identifié pour la première fois le rôle crucial de la voie extrinsèque de l’apoptose en aval du récepteur de mort FAS (First Apoptosis Signal) dans les lésions d’IR (Roubille et al, Circulation 2007). Notre approche pharmacologique peptidique permet d’inhiber l’apoptose en bloquant l’interaction FAS:DAXX ou FAS:FADD. Ces peptides injectés à la reperfusion permettent de protéger le myocarde sur le long-terme. Ils sont actuellement testés sur des souris avec comorbidités (vieillissement, diabète) et seront évalués en clinique par la start-up ApoRepair.
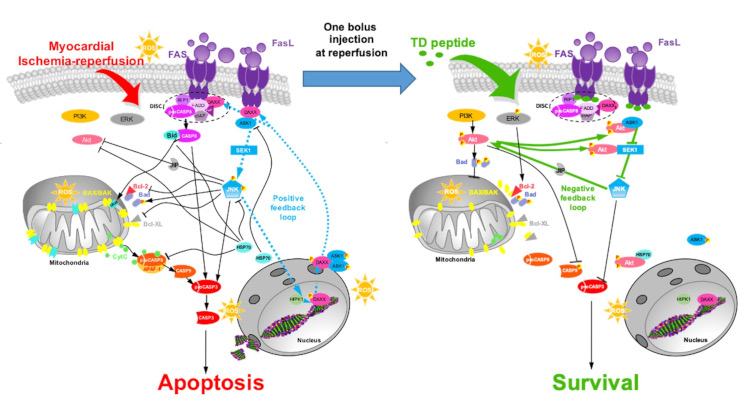
Représentation schématique des cascades apoptotiques et de survie affectées par le traitement Tat-DAXXp. (A) Schéma présentant les cascades de signalisation apoptotiques activées lors de l’ischémie-reperfusion myocardique impliquant DAXX. (B) Schéma récapitulatif du mécanisme d’action du peptide Tat-DAXXp administré au début de la reperfusion et conduisant à l’inhibition des voies extrinsèque et intrinsèque ainsi qu’à l’activation des kinases de survie. Dans les deux schémas, les boucles de rétroaction régulant le rapport nucléo-cytoplasmique de DAXX représentées (d’après Boisguérin P. et al., Cardiovasc Res 2020).
Principales publications
• Fernandez Rico C. et al. (2022). Frontiers in Cardiovascular Medicine; 9:792885.
• Covinhes A. et al. (2020). Scientific Reports;10(1):18116.
• Boisguerin P. et al. (2020). Cardiovascular Research ;116(3):633-644.
• Boisguerin P. et al. (2011). Journal of Control Release;156(2):146-53
• Roubille F. et al. (2007) Circulation; 116 (23):2709-17.
Financements
• 2023-2025 Fédération Française de Cardiologie – Coordinateur
• 2021-2024 ANR 2020-NanoCard – Partenaire
• 2019-2023 Fondation de France – Coordinateur
• 2017-2019 Contrat Prématuration Région Occitanie PepCard – Coordinateur
• 2017-2021 ANR 2017-HFADD – Coordinateur
• 2014-2017 Contrat de prématuration SATT AxLR – Coordinateur
• 2014-2017 Contrat de collaboration de Recherche CNRS-SERVIER – Coordinateur
• 2013-2015 Contrat FEDER CardioPep – Coordinateur
• 2012-2014 ANR 2012-PepFAS – Coordinateur
• 2009-2011 ANR 2008-MYOCARDAXX – Coordinateur
Collaborations
• Prisca Boisguérin, PhyMedExp, Montpellier
Alumni
• Carlota Fernandez-Rico (2019-2023)
• Laura Gallot (2012-2013)
• Alicia Franck-Miclo (2009-2012)
• Christelle Redt-Clouet (2009-2011)
• Aurélie Covinhes (2008-2009)
• François Roubille (2005-2008)
Brevets
• Licence exclusive d’exploitation de brevet WO 2012/066376.
• Barrere S., Nargeot J., Lebleu B., Boisguérin P., Piot C. EP2982685A1, 2017
• Barrere S., Nargeot J., Lebleu B., Boisguérin P., Piot C. WO 2012/066376, 2012
Préconditionnement des cellules souches/stromales mésenchymateuses par PPARβ⁄δ
Notre projet de thérapie cellulaire permet de cibler les lésions d’ischémie-reperfusion myocardique avec des cellules souches/stromales mésenchymateuses. Nous avons mis en évidence le rôle crucial du récepteur PPARβ/δ dans les propriétés thérapeutiques cardioprotectrices des CSM (Nernpermpisooth et al, Front Cardiovasc Med 2021). Nous avons montré que le préconditionnement des CSM avec un agoniste de PPARβ/δ, avant de transplanter ces cellules lors de la reperfusion, permettait d’augmenter leur résistance au stress de la transplantation et leurs propriétés anti-apoptotiques (Sarre et al, Stem Cell Res Ther 2022).
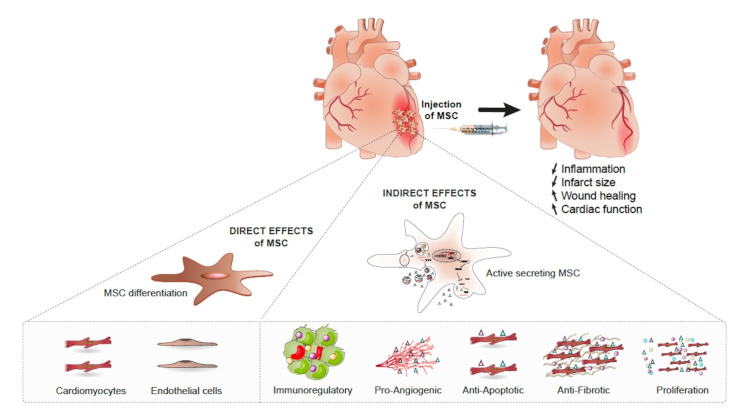
Propriétés pléiotropes des cellules souches/stromales mésenchymateuses dans l’IDM.
Les effets cardioprotecteurs des CSM sont médiés directement par la capacité des CSM à se différencier en cellules cardiaques. La protection est médiée prioritairement par des effets indirects en inhibant la réponse immunitaire et l’apoptose tout en augmentant l’angiogenèse et la prolifération des cellules cardiaques (d’après Barrère-Lemaire S. et al., Physiological Reviews 2024).
Principales publications
• Barrère-Lemaire S., et al. (2024). Physiological Reviews;104(2):659-725.
• Sarre C., et al. (2022) Stem cell research & Therapy; 13:167.
• Nernpermpisooth N., et al. (2021) Frontiers Cardiovascular Medicine; 8:681002.
Financements
• 2022-2023 Région Occitanie (Contrat de Recherche Prématuration)
• 2021-2024 Contrat FRM Postdoctorat
• 2020-2021 Contrat Collaboration de recherche – Cell Easy – SATT AxLR
• 2020-2021 Programme maturation SATT AxLR
• 2017-2020 Bourse de thèse Fonds Elizabeth Brancher
Collaborations
• Farida Djouad, IRMB, Montpellier
• Patricia Luz‑Crawford, Laboratorio de Imunologica Celular y Molecular, Facultad de Medicina, Universidad de los Andes, Santiago, Chile.
• Sarawut Kumphune, Biomedical Engineering Institute, Chiang Mai University, Thailand;
• Nitirut Nernpermpisooth, Department of Cardio-Thoracic Technology, Faculty of Allied Health Sciences, Naresuan University, Phitsanulok, Thailand
• Kantapich Kongpol, School of Allied Health Sciences, Walailak University, Nakhon Si Thammarat, Thailand
Alumni
• Rafael Contreras (2021-2023)
• Charlotte Sarre (2017-2020)
• Kantapich Kongpol (2019-2020)
• Sanit Jantira (2018-2019)
• Nitirut Nernpermpisooth (2016-2017)
Brevets
• Djouad,F., Barrere-Lemaire S., Jorgensen C. WO2022129468A1, 2022.
Recherche de nouvelles cibles pour la cardioprotection
Notre équipe développe des thérapeutiques ciblant la signalisation calcique intracellulaire (LabEx ICST), qui joue un rôle clé dans les mécanismes de survie, de contraction, de rythme et de mort cellulaire. Nous avons identifié les mécanismes endogènes de la cardioprotection médiée par le postconditionnement ischémique. Nous avons identifié comme cibles de la cardioprotection mGluR1 (Vincent et al, Cardiovasc Res 2017) et Cav1.3 (Delgado et al, Front Cardiovasc Med 2023) et développé une approche multi-cibles basée sur MLC901 TCM (Vincent et al, Sci Rep 2017).
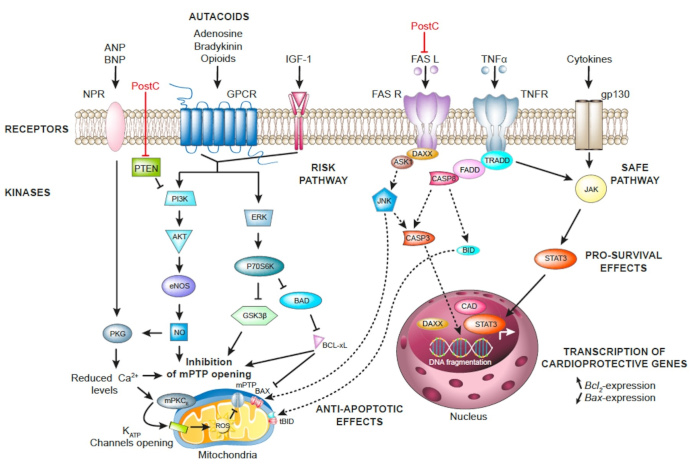
Mécanismes endogènes de cardioprotection.
Lors d’un stimulus de postconditionnement (PostC), des autacoïdes (adénosine, bradykinine, opioïdes endogènes) sont libérés et se fixent à leurs récepteurs spécifiques appartenant à la superfamille des GPCR. Les voies de signalisation RISK comprenant des kinases de survie telles que PI3K/AKT et ERK1/2 (p42/44) sont des cascades en aval activées par le stimulus PostC. PTEN est un puissant régulateur négatif de l’activité de PI3K. Le point final de cette cascade intracellulaire est l’inhibition de l’ouverture du MPTP via l’inhibition de GSK3β, l’augmentation de l’activité du NO (via AKT) et de la PKG (via les récepteurs des peptides natriurétiques) et la réduction des niveaux de Ca2+ intracellulaires. L’ouverture des canaux KATP mitochondriaux fait partie des points finaux des mécanismes de PostC.
La voie SAFE médiée par JAK-STAT3 est également responsable des effets cardioprotecteurs induits par le PostC. STAT3 se déplace vers le noyau afin de contrôler la transcription des gènes cardioprotecteurs tels que Bcl-XL. Les effets cardioprotecteurs du PostC résultent également de l’inhibition des voies apoptotiques (lignes pointillées) médiées par la voie extrinsèque impliquant des récepteurs de mort tels que les récepteurs FAS et TNF.
Principales publications
• Mesirca et al. (2024). Nature communications; 15(1):54.
• Kumphune S. et al. (2023). Frontiers in cardiovascular medicine; 10:1260800
• Delgado-Betancourt V. et al. (2023). Frontiers in cardiovascular medicine;10:1134503
• Vincent A. et al. (2017). Scientific Reports;7(1):14701.
• Vincent A. et al. (2017). Cardiovasc Research ;113(6):644-655.
Financements
• 2020-2025 ANR 2011-LABEX ICST
• 2020-2021 PHC SIAM Campus France.
• 2015-2016 Contrat collaboration MOLEAC EUROPE.
• 2014-2015 PHC SIAM Campus France.
• 2011-2020 ANR 2011-LABEX ICST
Collaborations
• Catherine Heurteaux, IPMC, Sophia Antipolis
• Michel Lazdunski, IPMC, Sophia Antipolis
• Sarawut Kumphune, Biomedical Engineering Institute, Chiang Mai University, Thailand
Alumni
• Kroekkiat Chinda (2016-2017)
• Delgado-Betancourt (2012-2015)


