Équipe Stéphanie BARRÈRE-LEMAIRE – Matteo MANGONI
Cardioprotection, physiopathologie du rythme cardiaque et ischémie
Projet Canaux ioniques, génération et régulation du rythme cardiaque
RESPONSABLE

Personnel IGF impliqué
Isabelle BIDAUD
IECE Inserm
Pietro MESIRCA
CRCN Inserm
Eleonora TORRE
Postdoc CNRS
Walma VASCONCELOS
Postdoc CNRS
Mélanie FAURE
Doctorante UM
Manon MARROT
Doctorante CNRS
Nadia MEKRANE
Doctorante UM
Eliane MORAIS-PINTO
Doctorante UM
Andrea CARA
AI CDD CNRS
Leïla TALSSI
IE CDD Inserm
Pinidmontree CHIRUTCHAYA
Doctorante (Univ Chulalongkorn, Thaïlande)
Pierre FONTANAUD
IECN CNRS
Angelo TORRENTE
CRCN CNRS
Anne Vincent
PU UM
Joël NARGEOT
DR Emérite CNRS
Christian BARRERE
IECE CNRS
Stéphanie BARRERE-LEMAIRE
DR1 CNRS
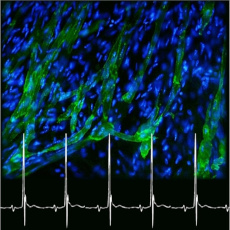
Nous développons un projet de recherche à long-terme visant à définir le rôle des canaux ioniques dans la génération et la régulation du rythme cardiaque au cours de la vie l’adulte, l’ontogénèse et l’évolution. Quatre composantes principales définissent le projet : (1) l’étude de la biophysique, de la pharmacologie spécifique et de la biologie structurale des canaux ioniques impliqués dans la génération de l’automatisme ; (2) l’exploration du rôle des canaux ioniques dans la génération et la régulation de l’automatisme cardiaque grâce une approche basée sur les souris transgéniques ; (3) le développement de modèles de dysfonction primaires (congénitale) et acquises de l’automatisme et de la conduction de l’activité électrique cardiaque et (4) l’étude de modèles cellulaires de l’automatisme basés sur la différenciation de cellules souches adultes et induites.
Canaux ioniques et voies de signalisation des myocytes pacemaker
Canaux calciques et arythmies cardiaques
Différenciation de myocytes automatiques à partir de cellules souches adultes du muscle squelettique
Canaux ioniques et voies de signalisation des myocytes pacemaker
Nous utilisons une collection unique de lignée de souris génétiquement modifiées dans lesquelles l’activité ou la régulation d’un ou plusieurs canaux ioniques à la base de la génération de l’automatisme et la conduction cardiaque ont été supprimés ou bien modifiée. Nous développons une approche multi-échelle de l’électrophysiologie cellulaire, du cœur entier et in vivo pour l’étude du rôle des canaux ioniques et leur régulation. Nous intégrons nos résultats dans des modèles numérique de l’automatisme.
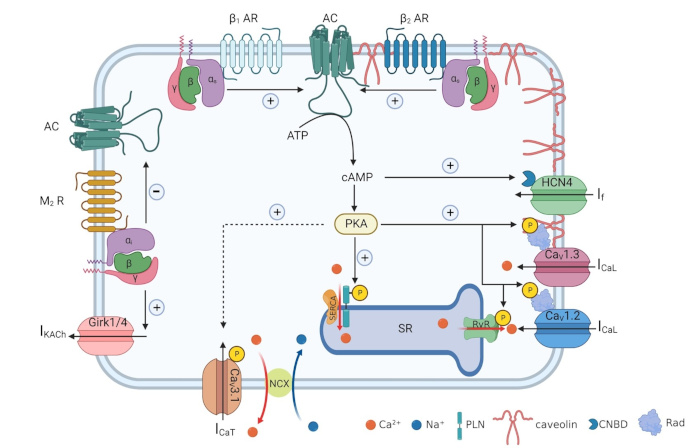
Schéma représentatif d’un myocyte pacemaker du nœud sinusal adulte. Les principaux canaux ioniques voltage-dépendants sont montrés ainsi que les voie de signalisation responsables de la régulation de l’activité pacemaker par le système nerveux autonome
Principales publications
• Mesirca et al. (2024) Nat Commun, 15:54. doi: 10.1038/s41467-023-43502-w.
• Louradour et al. (2022) Cells, 25,11,1114. doi: 10.3390/cells11071114.
• Baudot et al. (2020) Sci Rep, 10, 18906. doi: 10.1038/s41598-020-76049-7.
• Toyoda et al. (2017) Sci Rep, 7, 7869. doi: 10.1038/s41598-017-08191-8.
• Torrente et al. (2016) Cardiovasc Res, 109, 451, doi: 10.1093/cvr/cvw006.
Financements
• 2024-2027 ANR “L-type Cav1.3 (α1D) calcium channels as targets for controlling heart failure related ventricular arrhythmias” (CANTATA), Partenaire
• 2024-2027 Equipe Fondation pour la Recherche Médicale (FRM).
• 2024-2027 ERANet – ERA4Health-CARDINNOV – Partenaire.
• ANR 2023-2027. Defining the ionic bases of the fight-or-flight response of heart rate (IFOR) – Coordonateur
• 2023-2025 France-Canada Research Fund. Establishing a new model for understanding mechanisms driving cardiac functional performance. co-PI avec Emily Standen, Univ. Ottawa.
• 2020-2025 Fondation Leducq Transatlantic Network of Excellence “Fighting Against Sinus Node Dysfunction and Associated Arrhythmia”s (FANTASY) – Coordonateur Européen.
• Labex Ion channels Science and Therapeutics (ICST).
Collaborations
• Alicia D’Souza (Imperial College London, U.K.)
• Mark R. Boyett (Univ. Bradford, U.K.)
• Anna Moroni et Dario DiFrancesco (Univ. Milan, Italie)
• Steven O. Marx (Columbia Univ., NY, USA)
• Ana-Maria Gomez (Univ. Paris-Saclay, Orsay, France)
• Michel De Waard (l’Institut du Thorax, Nantes)
• Peter J Mohler et Vadim Fedorov (Univ. of Ohio, Columbus, USA)
• Dirk Isbrandt (Univ. Cologne, Allemagne)
• Gregoire Vandecasteele (Univ. Paris-Saclay, Orsay, France)
• Marta Campiglio and Valentina Di Biase (Medical University Innsbruck, Austria)
• Amy Lee (Univ. du Texas)
• Bernard Attali (Univ. de Tel Aviv, Israel)
• Emily Standen (Univ. d’Ottawa, Canada)
Alumni
• Julien Louradour (Thèse, 2018-2021)
• Matthias Baudot (Thèse, 2015-2018)
Canaux calciques et arythmies cardiaques
Les canaux ioniques tels que HCN4 et les canaux de type L- Cav1.3 génèrent l’automatisme et la conduction cardiaque. Leur expression fonctionnelle est généralement absente ou limitée dans le myocarde adulte, mais certaines conditions génétiques, physiologiques comme l’entrainement, les rythmes circadiens, le vieillissement, ou bien des états pathologiques tels que l’insuffisance cardiaque et la fibrillation atriale peuvent réguler ou altérer leur profil d’expression. Ces altérations peuvent être à la base des arythmies à fort impact sociétal. Nous développons un projet à long terme pour comprendre ces phénomènes de régulation physiologiques ou pathologiques et les cibler dans l’objectif de prévenir ces arythmies.
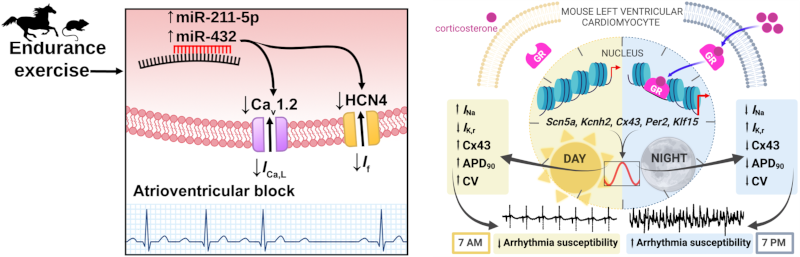
Image représentant une condition physiologique, l’entrainement chronique (gauche), ou le rythme circadien (gauche) régulent l’expression des canaux ioniques. De ce fait, l’entrainement est responsable d’un risque accru de bradycardie ou de bloc atrio-ventriculaire en activant l’expression de micro-RNAs réduisant l’expression des canaux. L’activité circadienne du récepteur au glucocorticoïdes (GR) est responsable de la régulation épigénétique des canaux sodiques cardiaques et des connexines, ce qui favorise la génération d’arythmies ventriculaires au réveil.
Principales publications
• Tikomirov et al. (2024) Circ Res, 134:1306-1326, doi: 10.1161/CIRCRESAHA.123.323464
• Al-Othman S, et al. (2024) Heart Rhythm. S1547-5271(24)00222-4. doi: 10.1016/j.hrthm.2024.02.050.
• Shrestha N, et al. (2023) Proc Natl Acad Sci U S A. e2210152120. doi: 10.1073/pnas.2210152120. Epub 2023 Jul 5.
• Mesirca et al. (2021) Annu Rev Pharmacol Toxicol, 61:757-778. doi: 10.1146/annurev-pharmtox-031120-115815
• Mesirca et al. (2016) PNAS,113, E932-41. doi: 10.1073/pnas.1517181113.
Financements
• 2024-2027 ERA-NET: ERA4HEALTH. SK4 K+ channel blockers: targeting calmodulin-PIP2 interface as new mechanism-based treatment of atrial fibrillation and heart failure – Partenaire
• 2024-2027 Equipe Fondation pour la Recherche Médicale
• 2020-2025 Fondation Leducq TNE Fighting Against Sinus Node Dysfunction and Associated Arrhythmias (FANTASY) – Coordonateur Européen.
Collaborations
• Alicia D’Souza (Imperial College London, U.K.)
• Mark R. Boyett (Univ. Bradford, U.K.)
• Henggui Zhang (Univ. Manchester, U.K.)
• Francis Marchlinski/Matthew Hyman (Univ. of Pensylvania, USA)
• Eric Schulze-Bahr (Univ. Münster, Allemagne)
• Peter J Mohler et Vadim Fedorov (Univ. of Ohio, Columbus, USA)
• Jean-Pierre Benitah (Univ. Paris Saclay, Orsay, France)
• Bernard Attali (Univ. de Tel Aviv, Israel)
Alumni
• Matthias Baudot (Thèse, 2015-2018)
• Antony Chung You Chong (Thèse, 2016-2019)
Différenciation de myocytes automatiques à partir de cellules souches adultes du muscle squelettique
Nous avons identifié une nouvelle population de cellules souche adultes dérivées du muscle squelettique (MDSCs) qui, après un stade de prolifération, présentent la capacité de différencier spontanément in vitro et in vivo en plusieurs type cellulaires, dont des myocytes présentant des propriétés de cellules pacemaker cardiaques. Nous étudions le mécanisme pacemaker de ces myocytes au stade différencié et leur capacité à améliorer la fréquence cardiaque in vivo et à restaurer l’effet chronotrope positif des catecholamines chez nos modèles de bradycardie associé à la perte de capacité chronotrope.
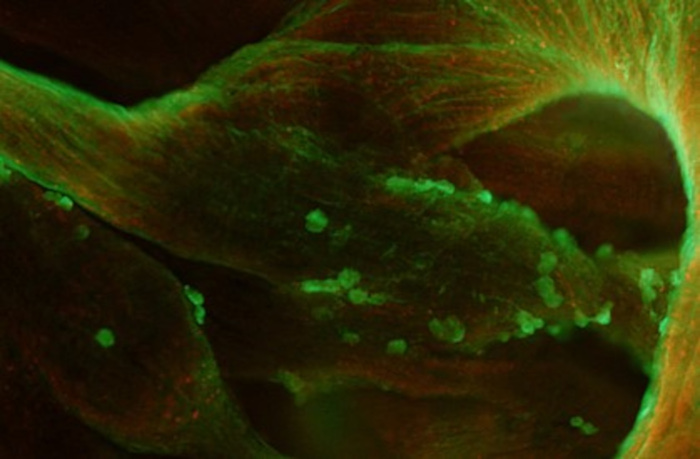
Image d’une région de l’oreillette droite montrant des MDSC (en vert) après administration par injection intraveineuse. Les MDSC se sont fixées sur les trabéculations par un processus de « homing » spontané dans le cœur. Les cellules sont ici encore au stade prolifératif (noter les cellules en mitose. Photo : Anne Fernandez, IGH, Montpellier.
Principales publications
• Mesirca et al. (2024) Biox XIV, https://doi.org/10.1101/393512
Financements
• 2023-2027 ANR. Defining the ionic bases of the fight-or-flight response of heart rate (IFOR) – Coordonateur
• 2020-2025 Fondation Leducq TNE Fighting Against Sinus Node Dysfunction and Associated Arrhythmias (FANTASY) – Coordonateur Européen
Collaborations
• Anne Fernandez (IGH, Montpellier)
• Ned Lamb (IGH, Montpellier)
• Daria Mamava (INM, Montpellier)
• Nicola Arsic (IGMM, Montpellier)
• Alicia D’Souza (Imperial College London, U.K.)
Alumni
• Matthias Baudot (Thèse, 2015-2018)
• Mattia Lorenzo DiFrancesco (Postdoc, 2012-2016)


