Les récepteurs membranaires sont essentiels dans la communication entre les cellules, et constituent ainsi la cible majeure des médicaments. Comprendre leur fonctionnement, leur dynamique, tant structurale que dans la cellule, sont autant d’informations essentielles dans la mise en place de nouveaux médicaments. Aujourd’hui, ces études sont pratiquement toujours réalisées sur des récepteurs recombinants, exprimés dans des cellules hétérologues. Or, il est maintenant reconnu que les propriétés des récepteurs peuvent grandement varier en fonction de leur environnement, de leur densité à la surface des cellules, des protéines accessoires avec qui ils s’assemblent, ou encore de leur localisation dans des sous-compartiments cellulaires, tant à la surface que dans des organelles intracellulaires. Il est donc essentiel de pouvoir étudier les récepteurs natifs dans leur environnement naturel, à savoir dans les cellules qui les expriment naturellement. Une approche essentielle pour suivre et étudier ces récepteurs, mesurer la fixation d’un ligand, suivre leur localisation et leur mouvement dans la cellule, nécessite leur marquage. Si l’utilisation d’anticorps marqués peut offrir des avantages, leur fixation réversible ainsi que la taille des anticorps peut largement en limiter leur utilisation.
Dans le cadre du contrat ANR Lanthslider impliquant deux équipes de l’IGF, l’équipe « Neurorécepteurs, dynamique et fonctions » animée par Philippe Rondard, et l’équipe « Physiopathologie de la transmission synaptique » animée par Julie Perroy, ainsi que le laboratoire de chimie dirigé par Amadeu Llebaria à Barcelone, et nos collègues de Revvity/Cisbio, une approche originale de marquage covalent d’un récepteur membranaire a été mise en place et validée. Cette approche consiste en la synthèse d’un composé comportant trois entités fonctionnelles : un ligand de haute affinité du récepteur, permettant de cibler le composé spécifiquement sur le récepteur, un groupement réactif qui peut former une liaison covalente avec un résidu lysine du récepteur, et un fluorophore. Un point essentiel de la réaction chimique avec la lysine, est la rupture du lien avec le ligand de haute affinité, si bien qu’une fois le fluorophore fixé au récepteur, le ligand est libéré, laissant intact et accessible le site d’activation du récepteur.
Ce travail a été mené avec succès par Xavier Gomez-Santacana, post-doctorant dans l’équipe de Philippe Rondard, en lien avec les chimistes de Barcelone et de Revvity, ce qui a permis de sélectionner le meilleur outil chimique pour marquer le récepteur D1 de la dopamine. Une optimisation du protocole a pu être réalisée grâce aux observations en microscopie réalisées par Marin Boutonnet, post-doctorant dans l’équipe de Julie Perroy. Enfin, la démonstration que le récepteur marqué est toujours fonctionnel a pu être apportée par Enora Moutin (chercheuse dans l’équipe de Julie Perroy) et Marta Cimadevila (post-doctorante dans l’équipe de Philippe Rondard).
Ce travail vient d’être accepté pour publication dans le journal Communications Chemistry.
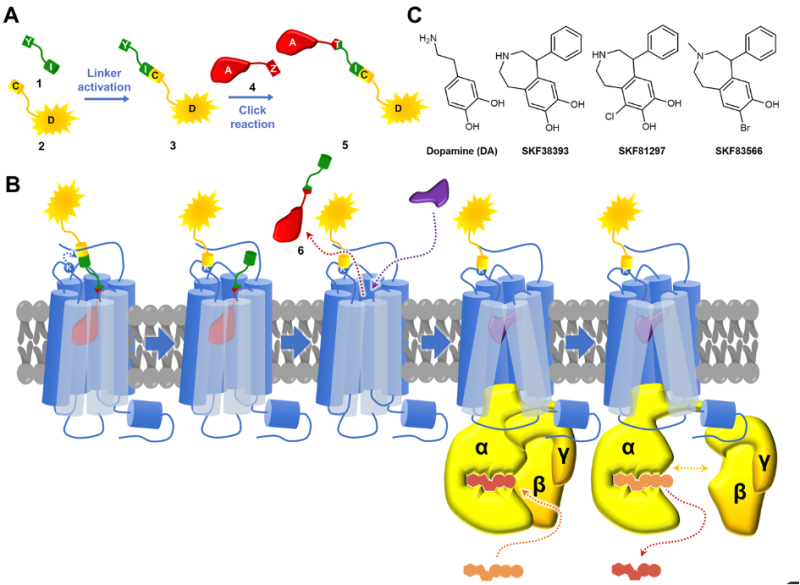
Schéma de la méthode de marquage covalent d’un récepteur. A) schéma de la construction de l’outil de marquage comportant un fluorophore greffé via un bras à un groupe réactif (jaune), associé à un ligand de haute affinité (rouge) via un linker (vert). B) suite à la liaison du ligand sur le récepteur, la réaction a lieu avec un résidu lysine, permettant de fixer de façon covalente le fluorophore au récepteur, libérant le ligand d’affinité. Cela rend alors le site d’activation libre. C) les ligands pouvant être utilisés pour marquer les récepteurs D1.


